概要
ユーロフィンジェノミクスでは最適化されたアミダイト合成法および高品質の原料を使用しております。独自に開発した合成プラットフォームを用いて、オリゴDNA合成における一連のカップリング・クリベージ・脱保護・脱塩の各工程を製造DBにて並列処理し、高速化を実現しています。 オリゴDNAは高いカップリング効率を実現しており、分子生物学研究におけるPCR、RT-PCR、シーケンシング、およびハイブリダイゼーションのような高い純度を要求される実験において使用前に精製する必要がないようデザインされています。 独自の合成技術に支えられた高いカップリング効率により、100塩基を超える長いオリゴDNAを高い収率で合成可能である他、多種多様な修飾も可能です。全てのオリゴDNAは厳密な品質管理のもとに製造されています。 ユーロフィンジェノミクスは、優れたテクノロジーと厳格な品質管理により、安定した品質の合成オリゴDNAを日々お客様にお届けしております。
合成法β-シアノエチルホスホロアミダイト法による固相合成。
合成装置ハイスループット自動オリゴDNA合成機を使用。
使用原料・アミダイト 最高水準の品質基準を満たす原料 ・反応溶媒(カップリング試薬、キャッピング試薬、酸化試薬等) ユーロフィンジェノミクス独自のレシピにより試薬を調製。この試薬により、高品質を実現しております。
修飾用試薬Glen Research社、Biosearch Technologies社、Molecular Probes社等、優良メーカーの試薬を使用しています。
合成最大鎖長160mer(161mer~は、お問い合わせください)。
精製OPC(カートリッジ)精製、逆相高速液体クロマトグラフィー(逆相HPLC)精製をご用意しています。
品質管理全品Tof-MSもしくは CE測定。
納品形態乾燥品、滅菌水あるいはTEバッファーによる溶解品。2mlチューブ、96ウェルプレートで納品。
受注システムウェブサイト、Emailオーダーフォームからのご注文は、配列情報が自動的に生産部へ転送されますので、配列入力のミスは発生しません。
製造ラインの品質管理
・品質検査は全数検査
・製造機器は専門のエンジニアチームが保守管理定期点検を実施
・重要な測定機器は全てメーカー保守契約締結
・製造システムはEurofinsグローバルで管理。
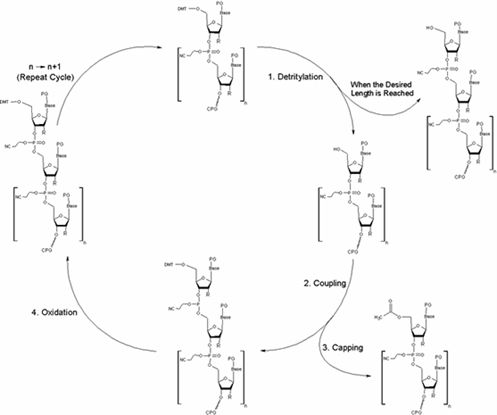
オリゴヌクレオチド合成サイクル
オリゴDNAの合成はCPGと呼ばれる多孔質の固相上で行われます。オリゴDNAの3'末端がCPGに固定されており、5'方向に一塩基ずつカップリングを行い伸長します。 カップリングの各ステップはホスホロアミダイトで誘導体化されたヌクレオシドがそれぞれ順に結合することにより行われます。このヌクレオシドには、3’-OH基に反応性のあるホスホロアミダイトが、一方5’-OH基にはジメトキシトリチル基がそれぞれ結合しています。ヌクレオシドのホスホロアミダイドと5’-OHが反応します。
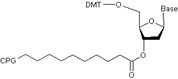
1.Detritylation:脱トリチル
保護基であるDMT基を一つ手前の塩基からクリベージすることで、5’末端を活性のあるOH基とします。
2.Coupling:カップリング反応
5’-OH基は次に結合する5’側塩基のホスホロアミダイト基と反応します。その結果、隣接する二つのヌクレオシドは互いに結合します。
3.Capping:キャッピング
化学反応であることから、隣接するヌクレオチドの結合において100%の結合効率を期待することは難しく、未反応が含まれます。5’側のヌクレオチドと結合しなかった5’-OH基は、次のカップリング反応時に反応しないようキャッピング(アセチル化)され、伸長が防止されます。
4.Oxidation:酸化反応
酸化ステップの後、次のヌクレオチドを結合するための合成サイクルが始まります(step1を参照)。このサイクルが繰り返され、目的の配列鎖長までヌクレオチドの結合が伸長されます。
PG=Protecting Group; R depends on the type of nucleic acid being synthesized.
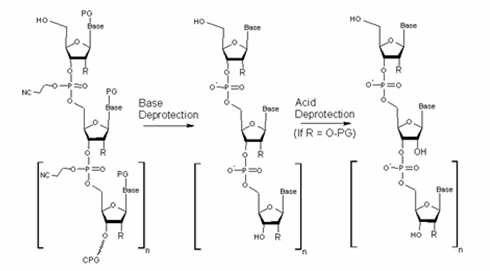
5.Deprotection: 脱保護
全ての合成サイクルを終えたあと、合成オリゴDNA鎖の最後の脱トリチル化を行います。次に固相CPGからのクリベージを行い、オリゴDNA側鎖の保護基を除去することで生物学的に活性のある合成オリゴDNAが生成されます。
オリゴDNAへの修飾方法
活性のある官能基に反応させたり、あるいはヌクレオチド誘導体を導入するなど、オリゴDNAは幾つかの異なる方法で修飾することが可能です。主なオリゴDNAへの修飾は以下の通りです。
3’あるいは5’OH基を利用した末端修飾
例:C6およびC7アミノ修飾、ビオチン-ON、ビオチン-TEG、コレステロール-TEG, フルオレセイン、チオール化、リン酸基
修飾塩基の挿入
例:5-ブロモ-デオキシウリジン、5-ブロモ-デオキシシトシン、5-フルオロ-デオキシウリジン、デオキシイノシン、5-ヨード-デオキシシトシン、5-ヨード-デオキシウリジン、5-メチル-デオキシシトシン、5-ニトロインドール、デオキシウリジン
チミジン誘導体によるT塩基の置換
例:アミノC2-デオキシチミジン、アミノC6-デオキシチミジン、ビオチン-デオキシチミジン、Dabcyl-デオキシチミジン、フルオレセイン-デオキシチミジン、TAMRA-デオキシチミジン 上記の修飾は塩基配列内部あるいは5’末端に導入可能です。また、一部の修飾は3’末端にも導入可能です。ただし、殆どの3’末端修飾は特別に調製されたCPGカラムが必要であるため、全ての3’末端修飾が可能というわけではありません。
合成後修飾
アミノ基を導入し、合成後に修飾する方法です。この方法ではクマリン、ジゴキシゲニン、オレゴングリーン、ROX、テキサスレッド、BODIPYなどの蛍光色素を結合させることが可能です。適切なアミノ基修飾を選択することで、これらの修飾を同じオリゴDNAの異なる位置にそれぞれ修飾することが可能になります。
リン酸基の修飾
例:ホスホロチオエート化
RNA合成
例:2’-O-メチル(A/C/G/U)、リボ(A/C/G/U)
注意: 未修飾の合成オリゴDNAは非常に安定な分子ですが、修飾が施された合成オリゴDNAの安定性は大きく変化する可能性があります。修飾オリゴDNAは光、pH、および凍結融解の繰り返しによって影響を受けやすく、安定性の視点から保存方法や取扱い方法に十分注意を払ってください。