よくあるご質問一覧
Q1. 人工遺伝子合成サービスとはなんですか?
Q2. 通常のクローニングと比べて時間がかかりませんか?
Q3. どれくらいの長さの合成遺伝子が可能なのですか?
Q4. 合成遺伝子の最適化はどのように行われますか?
Q5. Wizardで最適化できませんでした、どうすれば良いですか?
Q6. GENEiusとは何ですか?
Q7. スタンダード遺伝子とコンプレックス遺伝子とは何ですか?
Q8. オリゴDNA合成と遺伝子合成では、どのような違いがあるのですか?
Q9. 指定したベクターにクローニングしてもらうことは可能ですか?
Q10. 標準ベクターとはどのようなベクターですか?
Q11. どのような品質管理が行われていますか?
Q12. 遺伝子合成サービスを依頼するにはどうしたら良いですか?
Q13. 合成遺伝子はどのような用途に使えますか?
Q14. 合成遺伝子はどのようにデザインすればいいのでしょうか?
Q15. 人工遺伝子の合成方法について教えてください。
Q16. タンパク質に変異を導入する場合は、人工遺伝子合成(de novo合成)は有効でしょうか?
Q17. ベクターにライゲーションされていない二本鎖DNAとの違いは何ですか?
Q18. PCRで増幅できない塩基配列を合成できますか?
Q19. 混合塩基での合成はできますか?
Q20. 遺伝子の由来や性質によって合成できない場合がありますか?
Q21. 指定ベクターへのサブクローニング時に切断するサイトがなくてもクローニングできますか?
Q22. 出荷されるプラスミドはメチル化されていますか?
Q23. 最適化で希望の宿主がリストに無い場合は依頼できませんか?
人工遺伝子合成
Q1. 人工遺伝子合成サービスとはなんですか?
A1. 人工遺伝子合成はクローニングに変わる、次世代の遺伝子取得方法です。
塩基配列データをお送り頂くだけで遺伝子を合成致します。
ベクターにライゲーションされ、100%配列が保証された遺伝子を最短3営業日で出荷いたします。
発現宿主に合わせたCodon Usageの最適化(無料)など多様なサービスも併せてご利用頂けます。
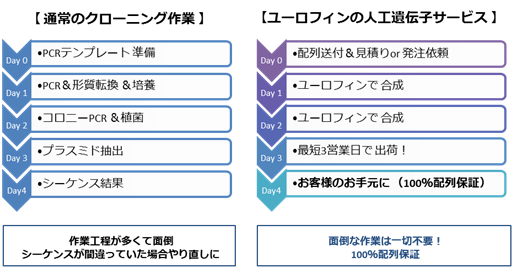
Q2. 通常のクローニングと比べて時間がかかりませんか?
A2. 人工遺伝子合成は最短3営業日で出荷いたします。
Q3. どれくらいの長さの合成遺伝子が可能なのですか?
A3. 100bp程度~数千bpの遺伝子まで、幅広く人工遺伝子の合成は可能です。下記ウィザードよりお気軽に見積をご依頼ください。
>オンラインオーダー(見積もり)ウィザード
Q4. 合成遺伝子の最適化はどのように行われますか?
A4. 最適化はアミノ酸配列を保持したまま、発現宿主のコドン使用頻度に塩基配列を適合させることによりタンパク質発現がスムーズに行われるようにするプログラムです。 (オンラインオーダー(見積もり)ウィザード上で最適化ができるようになっております) 下記のコンセプトに従い、当社独自の配列最適化プログラム"GENEius"により配列の最適化を実行しております。
・発現系の宿主において出現頻度が高いコドンを選択
・反復配列を可能な限り除外
・GC含有量を調整(40~65%)
・転写時の二次構造回避
など
コドン出現頻度(Codon Usage)はかずさDNA研究所のデータベースを元にしておりますが、お客様にご提供頂いたテーブルを使用して最適化を行うことも可能です。 (Web見積もりフォーム上では27種の代表的な種が選択できます。これら以外をご希望の場合にはotherを選択して頂き、メッセージ欄にご希望の生物種をご記載下さい) GENEiusはお客様の細かな要望にお応えするため、特定のコドンを回避、最頻コドンのみの選択、配列中に残したい配列の選択などが可能となっております Wizardでご希望の最適化が出来なかった場合には、フッターのE-mail宛までお問い合わせください。
Q5. Wizardで最適化できませんでした、どうすれば良いですか?
A5. 配列が長い場合や最適化条件が複雑な場合はWizard上で最適化が出来ない場合があります。
ご希望の配列、対象生物種、最適化条件をフッターのE-mail宛までお申し付けください。
Q6. GENEiusとは何ですか?
A6."GENEius"は、当社の10年以上にわたる遺伝子合成・タンパク質発現のノウハウ、および最先端の予測アルゴリズムを組み合わせて開発した、コドン使用頻度の最適化プログラムです。 本プログラムでは、以下のパラメーターを考慮して最適化を行います。
•1. コドン使用頻度
•2. 制限酵素部位
•3. 合成する遺伝子中に含めたくない配列
•4. GC、AT%と配列中での分布
•5. RNA二次構造の回避(反復配列、逆反復配列など)
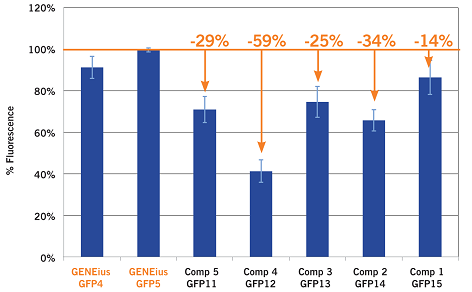
GENEiusおよび他社の同種プログラムとの間で、最適化後のタンパク質発現量の比較を実施しました。 以下のグラフに示すように、最大で50%以上優れていることがわかりました。
◆GENEiusテスト版はこちら
Q7. スタンダード遺伝子とコンプレックス遺伝子とは何ですか?
A7. 人工遺伝子の長さ、GC含量、繰り返し配列の有無、二次構造の存在などにより、合成が困難と判断されたものがコンプレックス遺伝子となります。
この場合ラボ担当者の配列確認が必要となるため、オーダーウィザードからのオーダーは出来ず、見積もり依頼のみとなります。
タンパク質発現が目的でアミノ酸配列が重要な場合には配列の最適化をして頂きますと、多くの場合スタンダード遺伝子となり、合成における追加料金なども発生しません。
Q8. オリゴDNA合成と遺伝子合成では、どのような違いがあるのですか?
A8. オリゴDNA合成は一本鎖のDNAを合成します。化学的なオリゴDNA合成反応では、長くなるほど反応効率が大きく低下するため、200base以上を確実に伸長させることは困難です。このような場合、合成産物は伸長反応が途中で止まった不純物を多く含む混合物で構成されております。
一方、人工遺伝子合成は二本鎖DNAを合成する技術で、数千bpの二本鎖DNA合成が可能です。品質管理ではクローンの配列をDNAシーケンス解析しますので100%配列が保証されています。
Q9. 指定したベクターにクローニングしてもらうことは可能ですか?
A9. オプションサービスとして承っております。
通常は標準ベクター(pUC系ベクター)を使用しています。
Q10. 標準ベクターとはどのようなベクターですか?
A10.pUC系のサブクローニング用プラスミドになります。 弊社で使用している代表的なベクターにつきましてベクターマップを掲載させて頂きます。 (基本的には以下のベクターに挿入されますが、挿入が困難な場合には他のベクターになる可能性もございます)。ベクターへの挿入方向は任意となります。
カナマイシン耐性
pEX-K4J1
pEX-K4J2
アンピシリン耐性
pEX-A2J1
pEX-A2J2
Q11. どのような品質管理が行われていますか?
A11. 人工遺伝子合成ラボにおいて、DNAシーケンス解析により配列確認を行い、100%の配列正確性を確認しております。出荷時には品質保証書(Gene Synthesis Documentation)を製品に添付しています。
Q12. 遺伝子合成サービスを依頼するにはどうしたら良いですか?
A12. オンラインオーダーウィザードにて受付けております。オンラインオーダーウィザード オンラインオーダーウィザードでは、お客様ご自身で遺伝子の最適化などを行って頂けます。 そのままオーダーもでき、見積もりのみお送り頂くことも可能ですので、是非オーダーウィザードをご利用下さい。
ウィザードがご使用になれない場合や、複雑な最適化などをご希望の場合にはフッターのE-mail宛まで配列などをお送りください。 ご依頼到着後、すみやかに御見積をご案内差し上げます。
Q13. 合成遺伝子はどのような用途に使えますか?
A13.遺伝子と関連のあるあらゆる分野での使用が可能です。代表的な例として、遺伝子発現の最適化、タンパク質の発現・タンパク質発現のためのコドン最適化、リアルタイムPCR・標準的なPCRのスタンダードとしての利用、変異研究、ハイブリッド遺伝子の作製、マウス抗体のヒト化、あるいはDNAワクチンの製造などがあります。
PCRでクローニングを行う際に増幅が困難な配列の場合には塩基配列の最適化を行うことで、アミノ酸配列を変えずに目的のタンパク質を得ることができます。
最近ではCRISPR-Cas9系などでのゲノム編集でのご利用も増えてきております。
特にノックインなどの長い相同配列が必要な場合にはオリゴDNA合成よりもコスト、品質的に有利です。
用途について疑問点やご要望がありましたら、フッターのE-mail宛までお問い合わせください。
Q14. 合成遺伝子はどのようにデザインすればいいのでしょうか?
A14. コドン出現頻度(Codon Usage)の最適化をご希望の場合は特にデザイン上のポイントはありません。ご希望の配列をお送り頂ければ、弊社独自のアルゴリズムで最適化し、お客様に配列の提案をさせて頂きます。
ただし、最適化を行わない場合には、以下の要素が遺伝子配列内に含まれると合成が困難となる可能性があります。可能な限りこれらの要素を含まないようデザインしてください。
・4個以上の塩基から成るヘアピン構造の生じる可能性の高い配列
・繰り返し配列を含む構造(正位、逆位)
・単一または2個のヌクレオチドの反復が長く続く配列
・GCまたはAT含量が局部的、全体的に高い配列
他のベクターへのサブクローニング等をご予定の場合は、ご依頼配列の両末端に制限酵素認識配列を付加する事をお薦め致します。 デザインについて疑問点やご要望がありましたら、フッターのE-mail宛までお問い合わせください。
Q15. 人工遺伝子の合成方法について教えてください。
A15. 合成遺伝子の合成方法には3種類の代表的な方法があります。
1. Khoranaらが開発した方法(Gupta et al., 1968) まず、配列がオーバーラップした一連のオリゴヌクレオチドを合成します。オリゴの相補的配列がアニーリングすると、両鎖にニックを含む二重鎖DNA断片が形成されます。このニックをDNAリガーゼで修復します(DNAリガーゼは、二重鎖オリゴ断片の5´-リン酸と、隣接する二重鎖オリゴ断片の3´-ヒドロキシ末端との間にホスホジエステル結合を形成させる反応を触媒する酵素)。
2. Narangらが開発した方法(Scarpulla et al., 1982) DNA-ポリメラーゼIという酵素の大サブユニット(Klenow fragment)が有する、鋳型に基づきプライマー依存的に5´から3´方向に合成する能力を利用します。オリゴの端と端をアニーリングさせると、Klenow fragmentがデオキシヌクレオシド三リン酸を用いてギャップを埋めていくのです。結果として得られた二重鎖DNAのニックは、DNAリガーゼで修復します。
3. Rossiらの開発した方法(Rossi et al., 1982) 非常に長いオリゴヌクレオチド鎖を合成するのに有効です。まず、2本の長いオリゴを合成し、アニーリング時に3´-末端同士をオーバーラップさせます。欠損した塩基をDNAポリメラーゼで補い、全長の二重鎖を完成させます。ポリメラーゼ処理後に、適切な制限酵素を用いて切断し、二重鎖断片に突出末端を作製します。
通常、これらの手順で遺伝子全長を作成した後、適切なベクターへクローニングします。
Q16. タンパク質に変異を導入する場合は、人工遺伝子合成(de novo合成)は有効でしょうか?
A16. 人工遺伝子合成は配列通りに100%の正確性で遺伝子を合成する技術です。そのため、変異導入する箇所が決まっており、配列が決定している場合には人工遺伝子合成が有効です。配列が決定しておらず、スクリーニングをされる場合にはエラープローンPCRなどが有効です。
Q17. ベクターにライゲーションされていない二本鎖DNAとの違いは何ですか?
A17. 弊社で提供させて頂いているのはベクターにライゲーションされたもので、配列が100%保証されています。
一方、PCR産物など、ベクターにライゲーションされていない二本鎖DNAは配列が完全に保証されていません。
ベクターに組み込まれていないことから、色々な配列の混合物と考えられます。
このような場合、お客様側でベクターに組み込んだ後、複数のシーケンスを確認する必要があります。
最悪の場合、正常なクローンが取れない可能性もございます。
Q18. PCRで増幅できない塩基配列を合成できますか?
A18.配列が既知なタンパク質(酵素)の場合にはアミノ酸配列を保持したまま、塩基配列を最適化することで可能です。
GC、AT Richな配列や繰り返し配列などがオリジナルの配列にあっても、最適化することで多くの場合これらの配列を回避することができます。
そのため、通常のPCRでは増幅できず、研究に利用できなかったタンパク質(酵素)などの解析が可能になります。
Q19. 混合塩基での合成はできますか?
A19. 混合塩基での合成はできません。 人工遺伝子合成では、合成した遺伝子をベクターに挿入後、大腸菌に形質転換し、シーケンスを確認した後に出荷させて頂いております。 そのため、混合塩基での合成はできず配列が一意に定まっている必要がございます。 配列中に変異を入れた複数の配列をご希望の場合には全ての配列を合成頂くか、基本となる配列を合成し、その後PCRにて混合塩基を使用したPCRを行い、お手元で取得して頂く方法がございます。
Q20. 遺伝子の由来や性質によって合成できない場合がありますか?
A20. 病原性ウイルスや微生物などの毒性や複製に関わる遺伝子や哺乳動物などへの病原性が確認されているものについては合成ができません。
P2レベルでクローニング作業が可能なものは人工遺伝子合成での対応が可能です。
P3以上の施設が必要な場合はフラグメントでの対応となります。(配列自体に病原性などを持たない場合に限る)
なお、BSLのご判断につきましては弊社側で確認いたしかねますので、お客様にて判断をお願いします。
Q21. 指定ベクターへのサブクローニング時に切断するサイトがなくてもクローニングできますか?
A21. 可能な場合もございますので、ご依頼時にご相談下さい。
Q22. 出荷されるプラスミドはメチル化されていますか?
A22. サブクローニング用に使用しております大腸菌はdam methylaseとdcm methylase活性を有しております。
そのため付加される制限酵素サイトによってはメチル化の影響により切断できない場合がございますので、配列設計時には十分にお気を付け下さい。
Q23. 最適化で希望の宿主がリストに無い場合は依頼できませんか?
A23. 最適化ご希望でリストに宿主が無い場合は以下の手順でご依頼が可能でございます。
<<ご希望テーブルがリストに無い場合>>
最適化の有無リストの最下位の「Other」を選択=>右に生物種名を記入できる欄が出現するのでそちらへ希望宿主をご記載ください。
その他、最適化条件を設定して進め、買い物かごから見積で依頼いただく。
途中の特記事項欄へ、かずさデータベースの希望テーブルのリンクを記載願います。
※コドンテーブルが無いため最適化が行われず元の配列が提示されますが、エラーではございません。
コドンテーブルはかずさのデータベース上にあるもので基本的にお願いしておりますが、
Codon Usage Database
データベース上に無いオリジナルのコドンテーブルの使用をご希望の場合は“orinigal table”等をご記入いただき
その他条件を設定してご依頼、コドン表は別途メールでご送付頂くことも可能でございます。
オリジナルコドンテーブルの場合はかずさのデータベースと同形式としていただく必要がございますのでよろしくお願いいたします。